O renomado poema de Samuel Coleridge ‘A Rima do Antigo Marinheiro‘ citou: ‘Água, Água, em todo lugar, nem gota para beber!’ Através destas famosas falas, Coleridge indicou que não tinha água para consumir apesar de estar rodeado por um oceano. Ele também mencionou que matou um albatroz (o que, segundo a tradição local, traz azar a todos no navio). É claro que, através de suas famosas falas, ele também reafirma o conhecimento comum de que 75% da superfície terrestre contém água. Além disso, sabemos também que 60% do corpo humano é composto por água. Assim, a água (uma molécula simples) revela-se crucial em todos os processos.
Para fazer com que os alunos aprendam mais sobre esse fenômeno conhecido (em detalhes), os professores universitários de química atribuem trabalhos de casa sobre as propriedades químicas do H2O, sua estrutura, importância ambiental, etc., para determinar sua profundidade de compreensão. No entanto, os estudantes, que não têm clareza sobre as propriedades químicas, a estrutura e o significado geral, muitas vezes lutam para compilar artigos exclusivos e bem pesquisados dentro do prazo apertado. Felizmente, vários sites notáveis de aulas particulares (como TopHomeworkHelper) oferecem ajuda 360 graus com a lição de casa de Química em tópicos básicos e avançados.
Sua tutoria personalizada permite que os alunos aumentem seu conhecimento do assunto/conceito, melhorem suas habilidades de redação acadêmica e preparem trabalhos dignos de submissão para obter notas excelentes. Você pode experimentá-lo se tiver dificuldades semelhantes na compreensão de tópicos específicos de química incluídos em seu currículo.
Porém, a seguir explicamos tudo sobre a cobertura do título com lucidez para ajudá-lo a começar seu dever de casa.
As propriedades químicas da água
Por ser uma substância química, (H2O) reage com muitas substâncias para formar vários compostos químicos.
Reacção redox: Como uma fonte maravilhosa de hidrogênio (tendo 2 átomos de hidrogênio ligados covalentemente com um átomo de oxigênio), os elementos eletropositivos diminuem as moléculas de hidrogênio.
Durante a fotossíntese, o H2O é reduzido e oxidado em O2, sendo vital para reações redox. (Ver exemplo)
![]()
Atmosférico por Natureza: Muitos devem saber que o H2O pode servir como base e ácido. Isso indica que, por natureza, é atmosférico. (Ver exemplo)
Comportamento ácido:
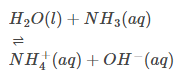
Comportamento Básico:
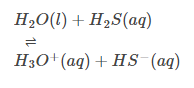 Reação de hidrólise: Também apresenta forte tendência hidratante principalmente devido à sua constante dielétrica e pode dissolver diversos compostos icônicos. Certos compostos iônicos e covalentes podem ser hidrolisados.
Reação de hidrólise: Também apresenta forte tendência hidratante principalmente devido à sua constante dielétrica e pode dissolver diversos compostos icônicos. Certos compostos iônicos e covalentes podem ser hidrolisados.
Seguro assistência com lição de casa da faculdade em TopHomeworkHelper.com e obtenha acesso gratuito a inúmeras soluções de respostas/notas de redação de química.
Mais sobre propriedades de H2O
- Massa molar – 8,01528(33) g/mol
- Densidade sólida – 0,9167 g/ml a 0 °C
- Densidade do líquido – 0,961893 g/mL a 95 °C, 0,9970474 g/mL a 25 °C, 0,9998396 g/mL a 0 °C
- Ponto de fusão – 0 graus C
- Ponto de ebulição – 100 graus C
- Acidez – 13,995
- Pressão de vapor – 0,032176 atm/3,1690 quilopascais
- Viscosidade – 0,890 cP
- Condutividade térmica –0,6065 W/m·K
- Índice de refração – 1,3330 (nD)
- Basicidade – 13,995 (pKb)
A Química da Estrutura da Água
A estrutura química da água consiste em 2 átomos de hidrogênio diferentes ligados a um único átomo de oxigênio. Devido à maior eletronegatividade dos átomos de oxigênio, possui ligações covalentes polares. O átomo de oxigênio atrai os elétrons compartilhados das ligações covalentes em maior extensão, em contraste com os átomos de hidrogênio. Conseqüentemente, os átomos de oxigênio ficam carregados negativamente (parcialmente), enquanto os átomos de hidrogênio recebem uma carga parcial positiva. Os átomos então adotam uma estrutura curvada devido a 2 pares de elétrons isolados no átomo de oxigênio. A forma curvada da molécula de água ocorre devido às ligações polares O – H não se cancelarem e a molécula inteira ser polar.
Além disso, as ligações polares atraem-se através das forças dipolo-dipolo (a extremidade positiva de uma molécula é atraída pela extremidade negativa da molécula próxima). Na água, as ligações polares O – H têm pouca densidade eletrônica perto dos átomos de hidrogênio, com cada átomo de H2 sendo atraído pelos elétrons solitários em um átomo de O adjacente. São chamadas de ligações de hidrogênio e são mais fortes do que qualquer força dipolo-dipolo normal.
Significância Ambiental
Com a população mundial crescendo a cada ano, a importância ambiental e as necessidades de água utilizável também crescem.
A água também é importante para alimentar, cultivar e nutrir várias plantas e animais (até mesmo para a movimentação e reprodução de peixes). Eventos rotineiros de rega para plantas com flores também fornecem alimento e abrigo para insetos, répteis, sapos e mamíferos. Mesmo as aves florestais respondem bem a zonas húmidas saudáveis. Eles podem facilmente alimentar-se e sair para polinizar plantas e regular insetos e pragas.
O público deve reconhecer o valor da água com maior relevância. A água limpa é crucial para a agricultura, pecuária, saneamento e sustentação do ecossistema circundante. A água ajuda a restaurar e manter o fluxo natural em rios, zonas húmidas, riachos, etc. e ajuda a sustentar os habitats das planícies aluviais.
Assim, é importante que o governo mundial e outros organismos oficiais responsáveis sustentem um sistema hídrico saudável, renovável e resiliente para o benefício de todos.
Source: A química da água: propriedades, estrutura e importância ambiental